2021年10月26日,新芽基因首席科学顾问、西湖大学常兴教授团队在Circulation期刊(IF:29.690)上发表了题为“Therapeutic Exon Skipping via a CRISPR-guided Cytidine Deaminase Rescues Dystrophic Cardiomyopathy In Vivo”的文章。该文章首次在全新的小鼠DmdE4模型上复现了人类杜氏肌营养不良症(Duchenne Muscular Dystrophy,DMD)患者的扩张性心肌病和心脏纤维化等心脏异常表型。利用DmdE4小鼠模型,一次性全身注射靶向性胞嘧啶脱氨酶介导的碱基编辑器(Targeted AID induced Mutagenesis,TAM)),使DmdE4小鼠心脏的肌营养不良蛋白(Dystrophin)恢复了90%的表达,且心肌和骨骼肌功能明显改善,DmdE4小鼠的生存期显著延长。
Dystrophin蛋白的缺失是导致DMD疾病发生的根本原因,DMD患者表现为进行性的心肌和骨骼肌的退化,在青少年或成人时致死率显著提升。虽然在近些年来,心衰已经上升为DMD病人的首要致死原因,然而现在并没有有效的治疗手段,部分原因也是因为没有合适的疾病模型。


常兴教授团队首先通过心脏超声、micro CT、肌力测试和组织学等方法验证了在DMD基因4号外显子中4个碱基缺失导致移码突变的DmdE4小鼠模型表现出心肌和骨骼肌功能缺陷。新生3天的DmdE4小鼠注射靶向DMD 基因4号外显子的AAV9-sgRNA和优化后的AAV9-CRISPR/Cas9-AID(eTAM)2个月后,肌酸激酶(creatine kinase,CK)水平明显降低,且肌肉张力得到明显改善,而心脏纤维化明显降低(图1)。
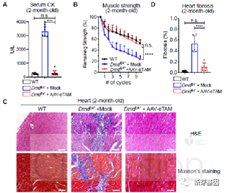
图1
通过生物学分析,发现DmdE4小鼠心脏的Dystrophin蛋白在mRNA水平实现了明显的外显子跳跃(图 2)。
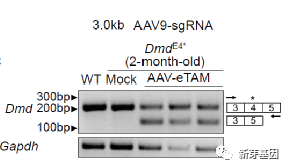
图2
在心脏组织的蛋白水平上,DmdE4小鼠治疗后的Dystrophin蛋白恢复可高达90%(图 3)。
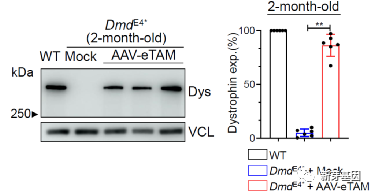
图3
通过免疫荧光试验,再次证实了eTAM治疗后DmdE4小鼠心脏的Dystrophin的表达,并与维持肌细胞膜稳定的Dystrophin相关蛋白质复合物(Dystrophin associated protein complex, DAPC)中另一个重要蛋白α-Sarcoglycan共定位在肌细胞膜周围(图 4)。
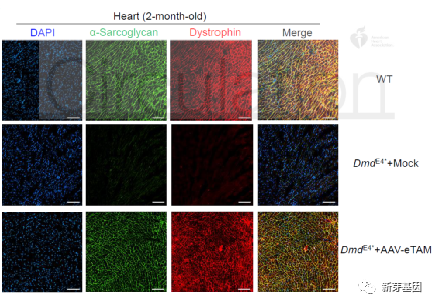
图4
治疗12个月后,DmdE4小鼠心脏组织中仍然能观察到明显的Dystrophin蛋白表达,这为后续临床上长期稳定的治疗效果提供了理论基础。不仅如此,与未治疗的DmdE4小鼠相比,eTAM治疗后的DmdE4小鼠寿命显著延长。
DMD的基因治疗药物主要为基因替代疗法,在研公司包括Sarepta, 辉瑞,Solid Bioscience。基因替代疗法装载的是一个只占全长Dystrophin蛋白30%长度左右的截短蛋白,而且疗效维持需要AAV长期持续表达。而eTAM技术作为一种高效的碱基编辑器,可以通过在一段时间内,将肌肉细胞中突变的DMD基因进行原位修复而不需要AAV的长期表达。被修复的肌肉细胞自己表达有功能的蛋白,从而可以达到一次治疗终生治愈的目的。eTAM技术还有潜力通过外显子跳跃治疗更多的其它人类单基因遗传病。
本文章涉及西湖大学专利已独家授权苏州新芽基因生物技术有限公司进行商业化开发。
原文:https://www.ahajournals.org/eprint/JMFIQRCX8CEITACZUAYF/full?redirectUri=%2Fdoi%2F10.1161%2FCIRCULATIONAHA.121.054628







